
Kalorimeter Pengertian Jenis dan Contoh Soal
Materi Kalorimeter laporan praktikum kalorimeter pendahuluan kalor pertama kali diamati oleh laouvisier yang dikenal teori kalorik. teori kalorik ini menyatakan. Skip to document. University; High School; Books; Discovery.. (Tim Dosen Fisika Dasar, 2015). Tujuan percobaan ini adalah mahasiswa dapat memahami prinsip kerja kalorimeter., dapat.

Dalam suatu kalorimeter direaksikan 100 cm3 larutan NaOH 1 M dengan 100 cm3 larutan HCI 1 M
mendapatkan nilai kalor suatu zat menggunakan kalorimeter aliran. 2.2 Dasar Teori 2.2.1 Kalorimeter Kalorimeter adalah alat yang digunakan untuk mengukur atau menentukan nilai kalor suatu zat.Prinsip kerja kalorimeter adalah menentukan aliran suhu, sehingga bisa untuk menentukan nilai kalor zat tersebut.Seperti hukum kekekalan
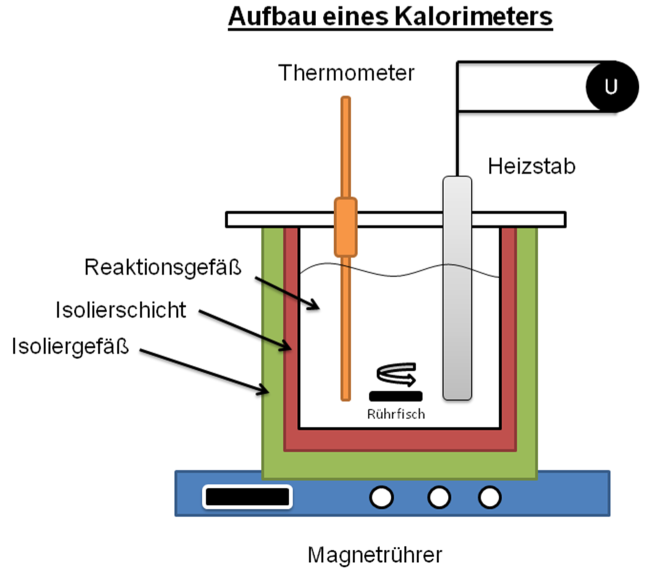
Kalorimetrie Physikalische Chemie OnlineKurse
B. Dasar Teori Kalorimeter merupakan alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia. Dimana pada kalorimeter akan terjadi perubahan energi dari energi listrik menjadi energi kalor sesuai dengan hukum kekekalan energi yang menyatakan energi tidak dapat diciptakan dan energi tidak dapat.
Penjelasan Mengenai Kalorimetri ( Termokimia Part IV ) Panduan Kimia + Riset
Jangan lupa sukai jika telah mengambil seluruh atau sebagian isi laporan praktikum semester ganjil kalorimeter nama praktikan diaz syafril dwi anggi nim. Skip to document.. Agar dalam menentukan suatu hasil mendapatkan hasil yang hampir sama atau mendekati dengan teori yang ada.. BUKU Fisika dasar 1 : DUA SATU PRESS Chang, R. 2004. Kimia.

Praktikum Fisika Dasar 1 Kapasitas Kalor Kalorimeter YouTube
Cara mengetahui kebenaran dari teori pembuatan kalorimeter sederhana dan cara penetapannya serta penentuan kalor reaksi, maka dilakukan percobaan "Termokimia".. BAB II DASAR TEORI Termokimia adalah ilmu yang mempelajari tentang perubahan kalor (panas) dalam reaksi kimia. Kalor merupakan salah satu bentuk energi.

KALORIMETER Menghitung Perubahan Entalpi dengan Kalorimetri Kimia kelas XI YouTube
Kalorimeter from pusatdata.netlify.app Pendahuluan. Kalorimeter kimia adalah alat yang digunakan untuk mengukur perubahan energi panas dalam suatu reaksi kimia. Pada dasarnya, kalorimeter ini digunakan untuk menentukan entalpi reaksi (ΔH) suatu reaksi kimia. Dalam artikel ini, kita akan membahas dasar-dasar teori kalorimeter kimia.

PPT PENGUKURAN DAN ANGKA PENTING PowerPoint Presentation, free download ID5323247
Pengukuran kalor jenis suatu benda, misalnya logam dilakukan dengan memasukkan logam panas ke dalam kalorimeter berisi air dingin. Ketika benda bercampur dengan air, suatu saat akan didapatkan suhu akhir campuran. Dengan menggunakan Asas Black, kita dapat menentukan kalor jenis suatu zat pada kalorimeter dengan menggunakan persamaan berikut.

Termodinamika DimanaMana Prinsip Kerja Kalorimeter
14. Penutup kalorimeter di buka, kalorimeter didekatkan sedekat mungkin dengan gelas kimia, lalu kubus materi di angkat dari dalam gelas kimia dan segera di masukkan ke dalam gelas kalorimeter kemudian ditutup kembali dengan rapat. 15. Kalorimeter di aduk sambil mengamati perubahan suhu yang ditunjukkan termometer.

kalorimeter YouTube
Kalorimeter - Pengertian, Prinsip Kerja,. Dual operasi dicapai dengan menambahkan Kalorimeter 1272 Ekspansi, Modul dasar 1271 Sistem. Contoh Perhitungan Kalorimeter. Terdiri atas: 1. Suatu kalorimeter bom berisi 250 ml air yang suhunya 25 o C, kemudian dibakar 200mg gas metana.

Kalorimeter zur Ermittlung der spezifischen Wärmekapazitäten von Flüssigkeiten Maschinenbau
Setelah menempuh matakuliah Praktikum Fisika Dasar, diharapkan mahasiswa dapat: 1. Merangkai alat dengan benar; 2. Menggunakan dan membaca skala alat ukur dengan benar; 3. Menulis abstrak laporan praktikum dengan benar 4. Menuliskan dasar teori ringkas yang mendukung percobaan; 5. Menuliskan langkah-langkah percobaan; 6.

Praktikum fisika dasar ll / Kalorimeter YouTube
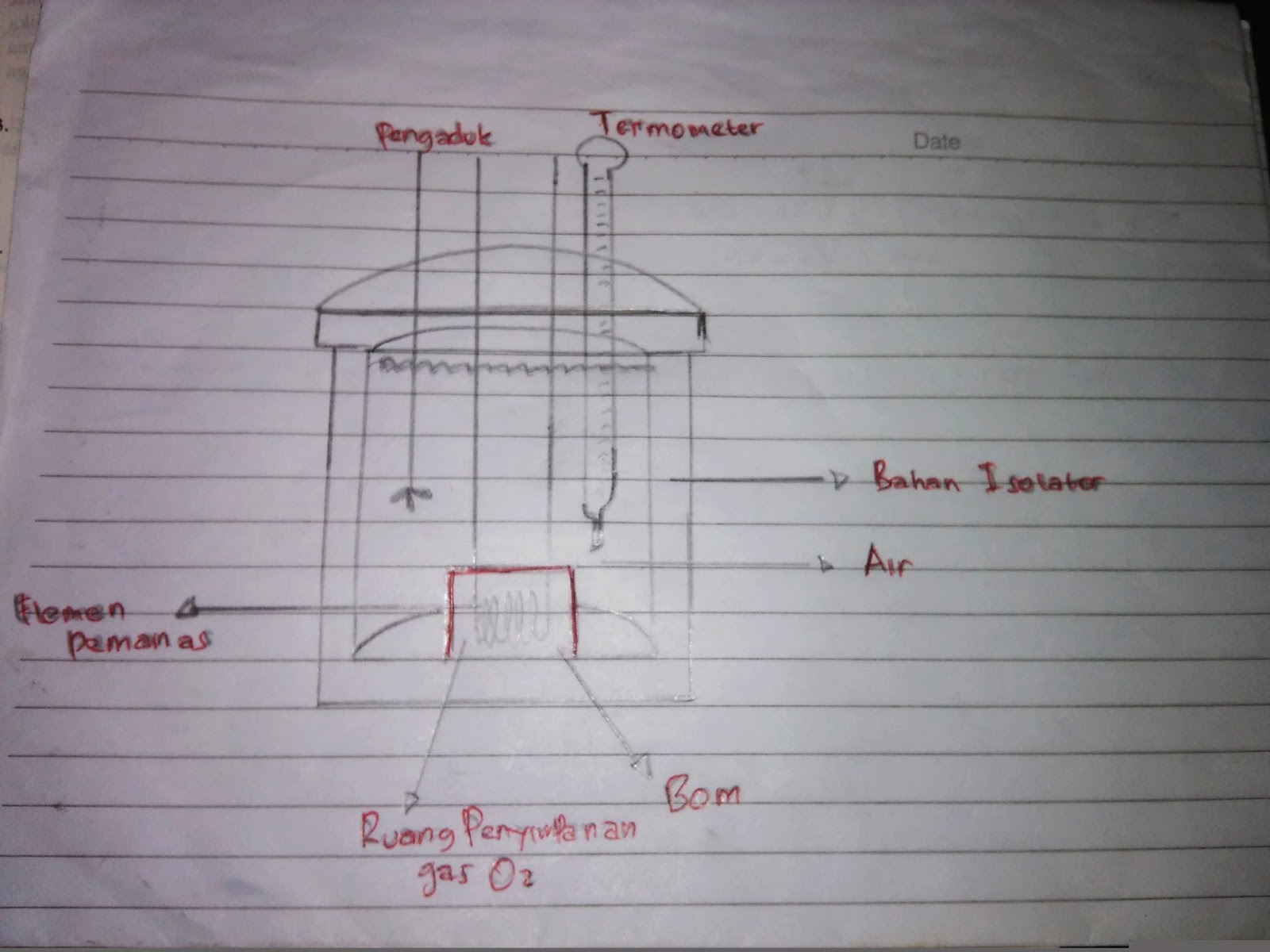
Sampel penelitian yaitu mahasiswa asisten laboratorium fisika dasar Unnes. Metode penelitian berupa Research and Development (RnD) model 4-D Thiagarajan,. namun pada akhirnya teori yang dibentuk harus diuji melalui eksperimen.. kalorimeter, (3) pemanas, (4) tabung bom, (5) thermometer, (6) penutup, (7) pentil sepeda, (8) selang.
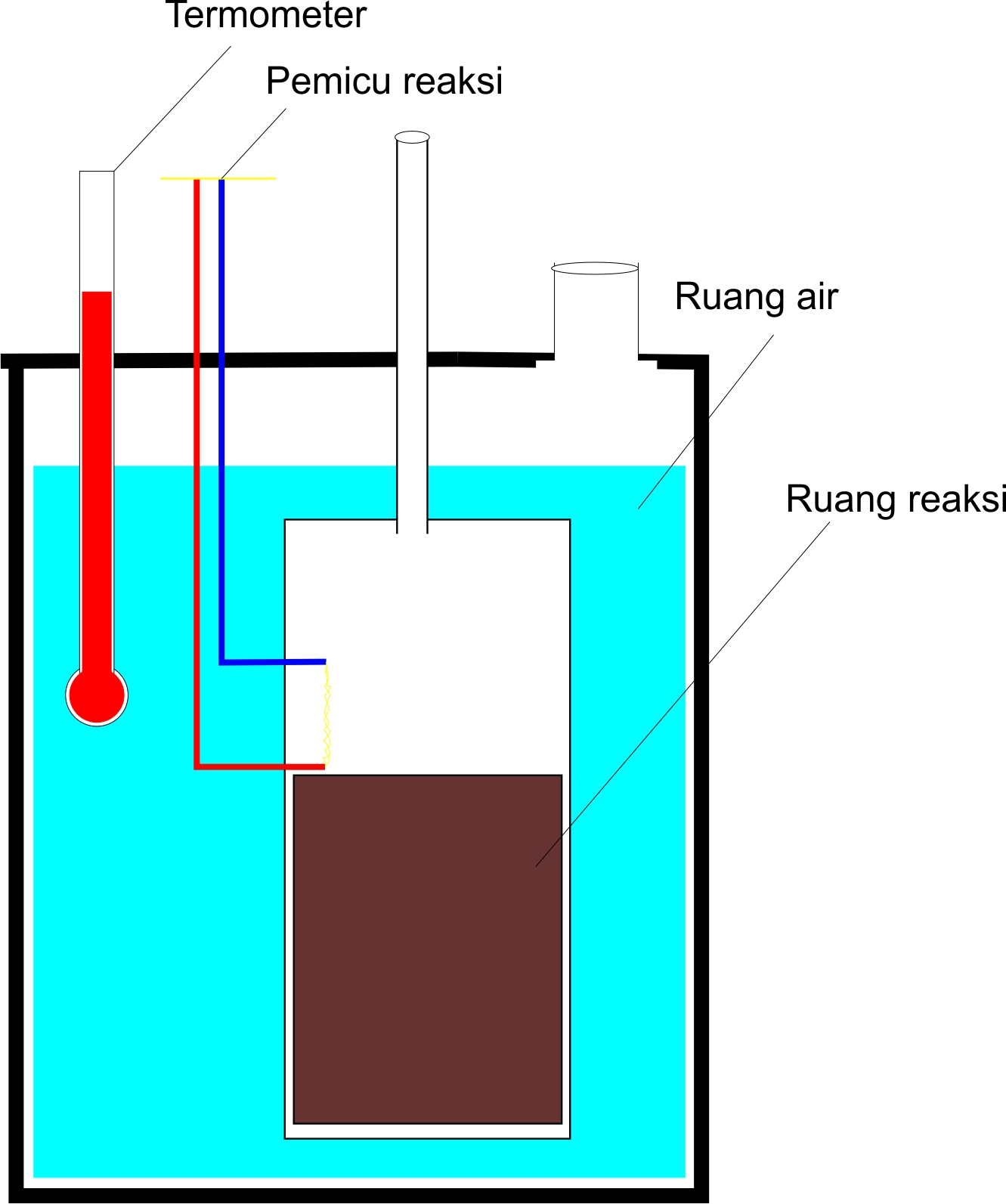
Cara kerja Kalorimeter
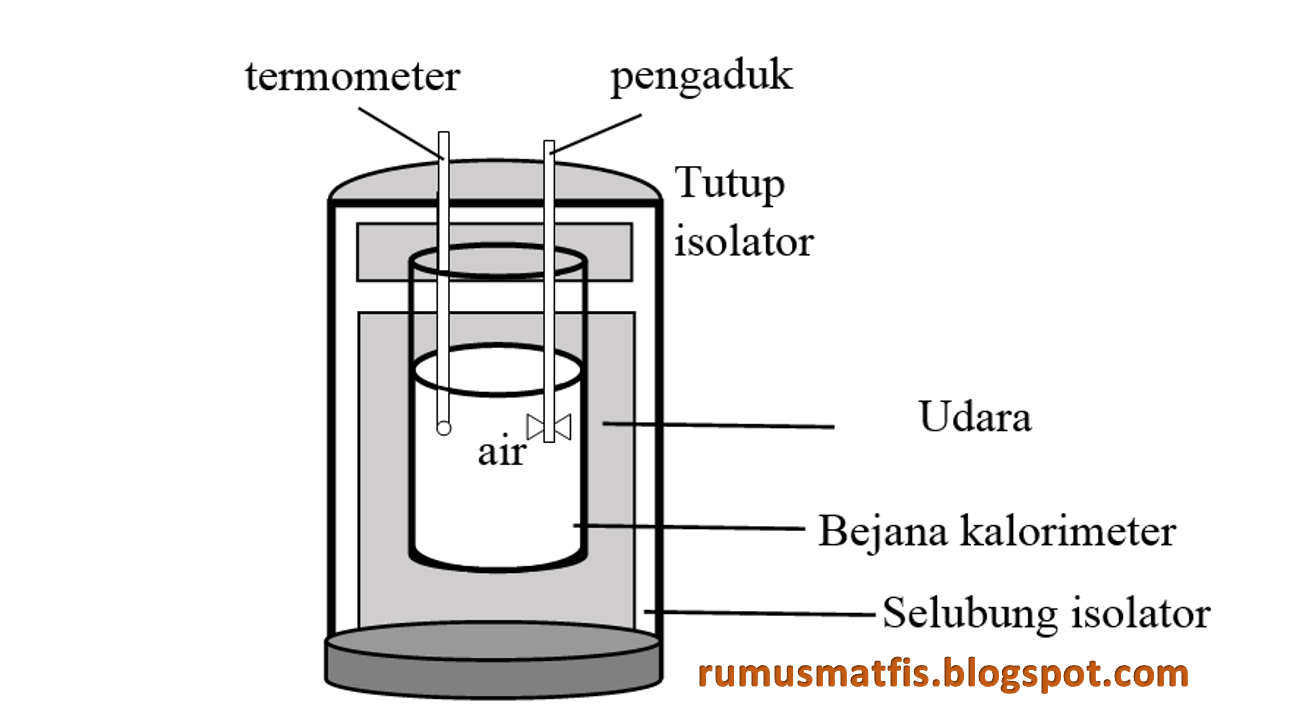
BAB 2 DASAR TEORI Kalorimeter merupakan suatu alat yang fungsinya untuk mengukur kalor jenis suatu zat. Salah satu bentuk kalorimeter adalah kalorimeter campuran. Kalorimeter ini terdiri dari sebuah bejana logam yang kalor jenisnya diketahui. Bejana ini biasanya ditempatkan didalam bejana lain yang agak lebih besar.

Praktek Kalorimeter Fisika Dasar
LAPORAN PRAKTIKUM FISIKA DASAR I KALORIMETER DAN KAPASITAS KALOR JENIS (M.2) Nama : Husnul Hatimah NIM : 1308205019 Tanggal Praktek : 25-November-2013 Dosen : Drs. Ida Bagus Alit Paramartha, M.Si. Asisten Dosen : I Gede Cahya Pradhana Mega Wahyu JURUSAN FISIKA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2013 Print to PDF without this message by purchasing novaPDF (http.

Soal Dan Pembahasan Kalorimeter
B. DASAR TEORI. Salah satu pengaplikasian dari hukum termokimia adalah percobaan yang akan dilakukan ini. Termodinamika merupakan sebuah ilmu yang mempelajari kalor yang mempelajari tentang perubahan fisik atau reaksi kimia yang menyertainya.. Tetapan kalorimeter dapat ditentukan dengan mengukur suhu campuran (Tc), suhu pada air dingin pada.
Kalorimeter
Laboratorium Fisika Dasar Jurusan Pendidikan Fisika FPMIPA UPI 1. Tujuan 1. Menentukan kapasitas kalor kalorimeter. 2. Menentukan kalor jenis zat padat. 3. Menentukan kalor lebur es. 2. Alat dan Bahan 1. Neraca [Ohauss, triple beam, 311 gram, 0,01 gram] 1 buah 2. Kalorimeter [bejana, pengaduk, tutup dan jaket] 1 buah 3. Termometer [-10 - 0 - 100]

Analisa Kalori dengan Bom Kalorimeter
Laporan praktikum ini menjelaskan tentang penentuan perubahan entalpi reaksi antara larutan HCl dengan NaOH menggunakan kalorimeter sederhana. Reaksi tersebut menghasilkan perubahan entalpi sebesar -84 kJ/mol yang menunjukkan bahwa reaksi tersebut bersifat eksoterm.